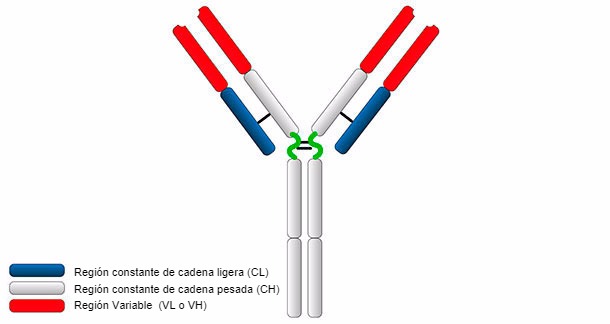
Hay cinco
tipos posibles de cadenas pesadas, que se definen con letras G, A, D, E y
M, y dos tipos de cadenas ligeras que se marcan con las letras
griegas Kappa (k) y Lambda (X). Cada inmunoglobulina individual (en
adelante, Ig) puede tener únicamente uno de los tipos de cadenas pesadas y uno
de los tipos de cadenas ligeras. En las personas que no padecen mieloma
encontramos todas las combinaciones posibles y las inmunoglobulinas son por
tanto policlonales. En el mieloma, como se ha mencionado, solo existe una única
combinación de cadena pesada y cadena ligera, la proteína monoclonal.
La papaína se presenta en forma de un polvo amorfo, granuloso de color blanco, grisáceo o parduzco; ligeramente higroscópico e insoluble en agua y en la mayoría de solventes orgánicos. La papaína es ampliamente empleado a nivel de la industria alimenticia, además de como ablandador de carnes, en la clarificación de cervezas y otras bebidas e incluso, en el tratamiento de cueros
Si una molécula de inmunoglobulina es tratada por proteasas, como la pepsina o la papaina, se parte en dos fragmentos denominados: Fab, de las palabras inglesas "antigen binding Fragment" y Fc (Crystalizable Fragment). En el primer fragmento (Fab), reside la especificidad de la inmunoglobulina, y por tanto su capacidad para reaccionar con el antígeno, mientras que el segundo fragmento (Fc) realiza las funciones efectoras de las inmunoglobulinas (fijación del complemento, receptores celulares, etc.)
Receptores Fcy
Tres clases de receptores Fcy humanos se han identificado FcyRI (CD64) FcyRII (Cd32) y FcyRII Todos los receptores son proteínas que pertenecen a la Superfamilia de moléculas tipo de inmuglobina
Receptores Fca se ha descrito varios receptores para IyA Estos receptores son el receptor polimérico Ig involucrado en el transporte epitelial de IgA
Receptores Fc en células fagocitas los anticuerpos IgG específicos para un antígeno en partículas reconocen a un agente patógeno a través de su porción Fab la región Fc queda libre en la dirección opuesta Las Células fagociticas pueden entonces unirse a estás regiones
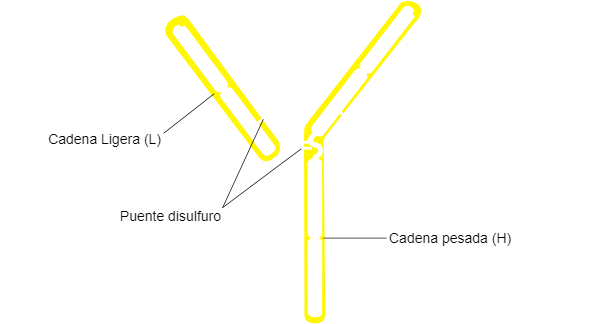
Los anticuerpos constituyen glucoproteínas plasmáticas globulares, llamadas Inmunoglobulinas. Son moléculas formadas por los linfocitos B maduros. La función del anticuerpo consiste en unirse al antígeno y presentarlo a células efectoras del sistema inmune.