
El sistema inmunitario fabrica anticuerpos para proteger al cuerpo de bacterias, virus y alérgenos. El cuerpo es capaz de fabricar distintos tipos de anticuerpos, o inmunoglobulinas, para luchar contra diferentes tipos de cosas o agentes patogenos que intentar acabar con el sistema inmunitario. Por ejemplo, el anticuerpo para la varicela no es el mismo que el anticuerpo para la mononucleosis. Existen 5 tipos básicos de inmunoglobulinas: IgG, IgM, IgA, IgD, IgE.
La IgG es la única clase de inmunoglobulina que atraviesa la placenta, transmitiendo la inmunidad de la madre al feto de manera natural y pasiva
Las inmunoglobulinas LGL son anticuerpos (Ab) o bien conocidas como inmunoglobulinas (Ig):
- Son producidos por linfocitos B estimulados por antígenos y diferenciados en células plasmáticas (células secretoras de anticuerpos, en inglés ASC: Antibody Secreting Cells)
- Secretados en fluídos corporales extracelulares.
- Capaces de unirse y atacar a patógenos extraños, neutralizándolos y eliminándolos a través de múltiples mecanismos
Las inmunoglobulinas LG tambien reciben el nombre de INMUNIDAD HUMORAL.El monómero de immunoglobulina tiene un peso molecular de 150-180 kDa y tiene una forma parecida a una Y.
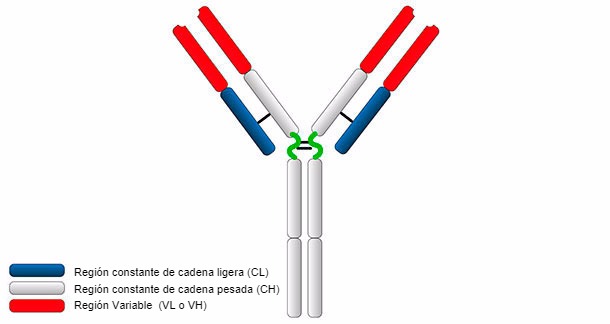
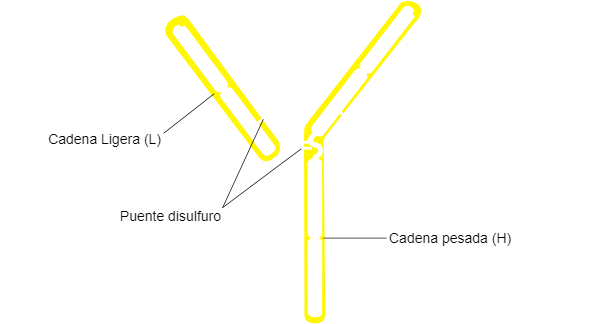
Estructura general de una inmunoglobulina.
La estructura típica de Ig consiste en dos cadenas pesadas H y dos cadenas ligeras unidas por puentes disulfuro. Ambas cadenas constan de dos partes, una región constante (C), y una región variable (V).
Las cadenas H y L tienen regiones o dominios donde la proteína se pliega para formar un área globular, denominada VH, CH y VL, CL, respectivamente. Las cadenas pesadas están formadas por una parte variable (VH) y tres (para IgG e IgA) o cuatro (para IgM e IgE) dominios constantes denominados CH1, CH2, CH3 y CH4. La cadena ligera puede ser del tipo λ o κ y está formada por dos dominios, uno variable (VL o VK) y otro constante (CL o CK). Los dominios VH y VL tienen regiones altamente variables denominadas CDRs (regiones determinantes de la complementariedad) que son el sitio de unión para un antígeno específico.
Hay una región bisagra entre CH1 y CH2 que permite la flexibilidad de las moléculas de Ig. La digestión de esta región bisagra con proteasas resulta en dos fragmentos Fab que contienen el sitio de unión del antígeno y un Fc (fragmento cristalizable) implicado en las funciones del anticuerpo.
Los dominios CH2 y CH3 son los sitios de unión para los receptores Fc, mientras que los dominios CH1-CL se unen al fragmento complementario C4b y el dominio CH2 se une al factor C1q del complemento.
Las cadenas pesadas (H) son idénticas entre ellas y
cada una de ellas está formada por alrededor de 450
aminoácidos. Las cadenas ligeras (L), también idénticas entre ellas, están formadas por más de 200 aminoácidos. La región media de las dos cadenas pesadas
también está unida por dos enlaces disulfuro y recibe
el nombre de región bisagra. La flexibilidad de la región
bisagra permite a un anticuerpo asumir una forma T o
una forma Y.
Hay cinco tipos de cadenas pesadas de inmunoglobulina en mamíferos: γ, δ, α, μ y ε. Estas definen las llamadas clases de las inmunoglobulinas.
- Las cadenas pesadas α e γ poseen aproximadamente 450 aminoácidos.
- Las cadenas pesadas μ y ε tienen unos 550 aminoácidos.
La región variable
es distinta para cada tipo de inmunoglobulina y tiene
dos lugares de unión al antígeno (bivalencia). La región
variable es responsable del tipo de reacción antígenoanticuerpo y su estructura sirve de base para distinguir
entre las clases de inmunoglobulinas.
No hay comentarios.:
Publicar un comentario